
《掘金创新药》由每日经济新闻联合丁香园Insight数据库共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
根据丁香园Insight数据库,10月18日至22日,国家药品监督管理局药品审评中心(CDE)共收到8家上市公司提交的13个化学新药、生物制品新药申请。

一周热点
《掘金创新药》研究员注意到,近期新冠药物研发领域捷报频传。11月4日,英国药品和保健品管理局(MHRA)宣布批准Molnupiravir上市;11月5日,辉瑞也公布其新冠小分子口服药Paxlovid的2/3期双盲对照临床试验数据,可使住院或死亡风险降低89%。
泽璟制药今年三季报数据显示,作为公司首款成功商业化的产品,甲苯磺酸多纳非尼片在上市后的三个月中贡献了接近1亿元的营收。在研发进展上,多纳非尼第二个申请上市的适应症于10月15日得到CDE受理。但与之形成对比的是,泽璟制药的股价展现出下行的趋势。
一周新药申请
本周上市公司方面,恒瑞医药(600276.SH)共申报5个临床申请;石药集团(01093.HK)申报2个临床申请;翰森制药(03692.HK)、君实生物-U(688180.SH)、中国生物制药(01177.HK)、先声药业(02096.HK)各申报1个临床申请;泽璟制药-U(688266.SH)、天士力(600535.SH)分别申报1个上市申请。

根据披露,按申请类别划分,本阶段申报类别情况如下:

一周“药”闻
君实生物PCSK9单抗昂戈瑞西单抗(研发代号:JS002)获批临床,联合PD-1特瑞普利单抗治疗晚期实体瘤。这是国内首个获批临床的PCSK9+PD-1联合疗法。
恒瑞医药发布公告称,其速效胰岛素改良型新药HR011408注射液获批临床,用于成人糖尿病。目前全球仅有诺和诺德Fiasp和礼来Lyumjev两款同类药物被美国和欧洲批准用于治疗糖尿病。
通化东宝(600867,SH)两款糖尿病产品同日获批上市,分别为门冬胰岛素注射液以及西格列汀二甲双胍(II),前者属于胰岛素专项集采的品种之一。
君实生物CD39单抗JS019临床申请获CDE受理。目前全球范围内仅5家企业研发CD39单抗,均处于早期临床。
诺华的SMA基因疗法Zolgensma在国内首次提交临床申请。此前曾以212.5万美元的价格登顶全球最贵药物之首。
一周热评
1类新药多纳非尼首单开出后三个月营收近亿元,泽璟制药股价却背道而驰
近日,泽璟制药发布公告称,公司于10月15日收到国家药品监督管理局下发的国家1类新药甲苯磺酸多纳非尼片(以下简称多纳非尼)用于治疗局部晚期/转移性放射性碘难治性分化型甲状腺癌(RAIR-DTC)适应症的新药上市申请的《受理通知书》。该适应症是继今年6月晚期肝细胞癌适应症获批上市后的第二个申请上市的适应症。
多纳非尼是泽璟制药自主研发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物。西南证券研报显示,多纳非尼既可抑制VEGFR、PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的Raf/MEK/ERK信号传导通路,具有多重抑制、多靶点阻断的抗肿瘤作用。
从化学结构来说,多纳非尼属于德国拜尔索拉非尼的氘代衍生物,在多纳非尼与索拉非尼头对头的临床试验中,多纳非尼在疗效和安全性上均要优于索拉非尼。但问题在于,索拉非尼已于今年2月纳入国家第四批药品集中采购,药品单价从95元下降到30元,但多纳非尼最高零售价格高达8266元/盒。并且,随着未来索拉非尼仿制药的上市,肝细胞癌用药市场的竞争还将进一步加剧。
公司管理层显然也看到了多纳非尼当下的定价困境,在公司披露的一份9月投资者关系活动记录表中,泽璟制药将联合用药作为未来开拓多纳非尼市场的途径。具体而言,目前多纳非尼已与君实生物的PD-1特瑞普利单抗联合治疗肝癌、胆管癌,与基石药业的PD-L1舒格利单抗联合治疗晚期肿瘤,与康宁杰瑞的PD-L1/CTLA-4双抗KN046联合治疗包括肝癌等的晚期消化道实体瘤,与嘉和生物的PD-1单抗GB266联合治疗晚期消化道实体瘤。
《掘金创新药》研究员关注到,尽管多纳非尼的各项研究正在有序推进,泽璟制药的股价却在核心产品获批上市后展现出下行的趋势,至今(11月8日)已较高点下跌约25%。此外,多纳非尼的商业表现也与公司股价背道而驰,从6月12日开出首单到9月底,多纳非尼在三个月内贡献近1亿元收入,公司的商业化能力得到初步验证。
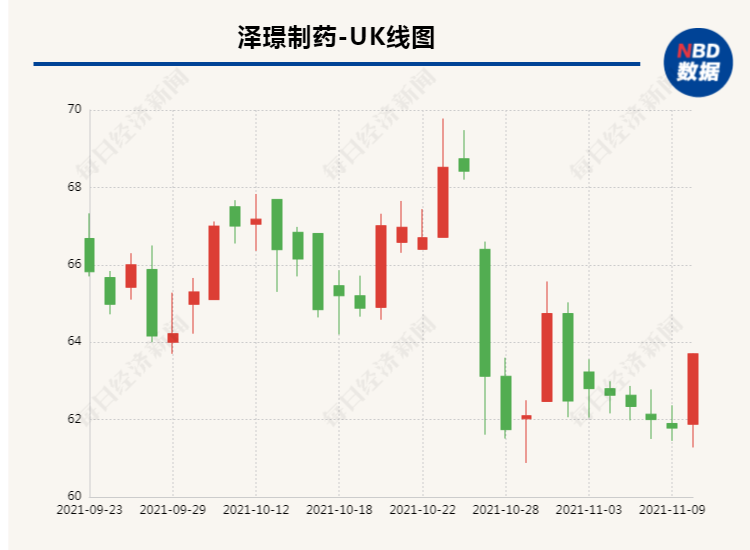
泽璟制药于半年报中透露,多纳非尼已于2021年7月31日通过了2021年国家医保药品目录调整的药品名单初步形式审查,公司正在积极准备后续的医保谈判工作。《掘金创新药》研究员认为,从既往肿瘤药被纳入医保的前后变化来看,多纳非尼在售价上应该有较大的下降空间,未来或也会对销售额有一定提振。但对于一线肝癌治疗这一竞争日趋激烈的市场,多纳非尼能够拿下多少份额,仍然有待市场的验证。
新冠治疗药物进入冲刺阶段,谁将笑到最后?
近期,新冠药物研发领域捷报频传。11月4日,英国药品和保健品管理局(MHRA)宣布批准Molnupiravir上市。这款药品是由默沙东和Ridgeback共同研发的核苷类似物,也是全球首个获批用于治疗轻、中度新冠成人患者的口服抗病毒药物。默沙东此前公布的III期临床数据显示,Molnupiravir能够将轻中度新冠患者的住院/死亡率降低50%。
而就在Molnupiravir正式批准上市的后一天(11月5日),辉瑞也公布其新冠小分子口服药Paxlovid的2/3期双盲对照临床试验数据,该试验针对1219名未接种疫苗的成年人展开。
试验结果显示,在症状出现后三天内接受治疗的患者中,与安慰剂组相比,Paxlovid能够使患有COVID-19的非住院高危成人的住院或死亡风险降低89%;28天时,用药组0.8%的患者住院(3/389住院,无死亡),而安慰剂组住院或死亡的患者为7.0%(27/385住院,7例死亡)。
据了解,Paxlovid的有效成分是蛋白酶抑制剂PF-07321332和低剂量ritonavir,PF-07321332可以抑制SARS-CoV-2-3CL蛋白酶活性,从而抑制新冠病毒的复制;与低剂量的ritonavir共同服用则有助于减缓PF-07321332的新陈代谢,以便延长药效。
对于Paxlovid高达89%的有效性,默沙东口服药Molnupiravir 50%的有效性“相形见绌”,这是否意味着对新冠患者来说,前者的疗效一定比后者更好?需要注意的是,单纯比较两个药物各自的临床数据并不严谨,只有经过头对头研究,才能排除因临床数据设置、入组患者情况等因素不同所造成的数据偏差。
但市场已闻风而动,截至11月5日收盘,默沙东下跌9.86%。此外,新冠疫苗企业更是因为新冠口服药物的利好消息连续两日遭遇重创,Moderna两日累计跌幅为31.49%、BioNTech下跌26.66%。
虽然Molnupiravir先行一步获批上市,但新冠治疗药物领域的市场格局还远谈不上尘埃落定。辉瑞也在公告中提及,由于试验结果显示出了压倒性的疗效,公司将停止进一步参与该研究,并计划尽快向FDA提交数据,以获得Paxlovid的紧急使用授权。据此判断,Molnupiravir或许就将在不久后面临Paxlovid的直接竞争;此外,也有部分专家认为应当探索Molnupiravir和Paxlovid联合用药的可能性,就像HIV鸡尾酒疗法,其同样是抑制RNA合成的核苷类+蛋白酶抑制剂这两种药物的混合。

 蒙公网安备 15010502001698号
蒙公网安备 15010502001698号