《2023中国罕见病行业趋势观察报告》正式发布
2022年2月25日,在2023年罕见病日即将到来之际,病痛挑战基金会和弗若斯特沙利文咨询公司(Frost & Sullivan,简称“沙利文”)联合举办的《2023中国罕见病行业趋势观察报告》(以下简称“《报告》”)发布会在线上顺利举办。
《2023中国罕见病行业趋势观察报告》是继去年病痛挑战基金会联合沙利文发布《2022中国罕见病行业趋势观察报告》之后,第二份年度趋势观察报告。《报告》旨在回顾梳理中国罕见病在诊断、用药、保障、特医食品及创新服务等方面的发展,概述这一领域在过去面临的问题和取得的进步,并对中国罕见病综合服务体系提出展望,希望对中国罕见病领域的政策制定者、倡导者、相关机构从业者、罕见病病友以及广大社会关注人群有所助益。
中国的现代化离不开人的健康,人的健康也涉及到罕见病患者的权益,用药和保障。中国罕见病联盟执行理事长李林康发表了开场致辞,呼吁大家尊重每一个罕见生命,一起携手共同推进中国罕见病的防治事业,点亮罕见病病友的生命之光。
罕见病药物可及性提高,70%治疗药物纳入医保
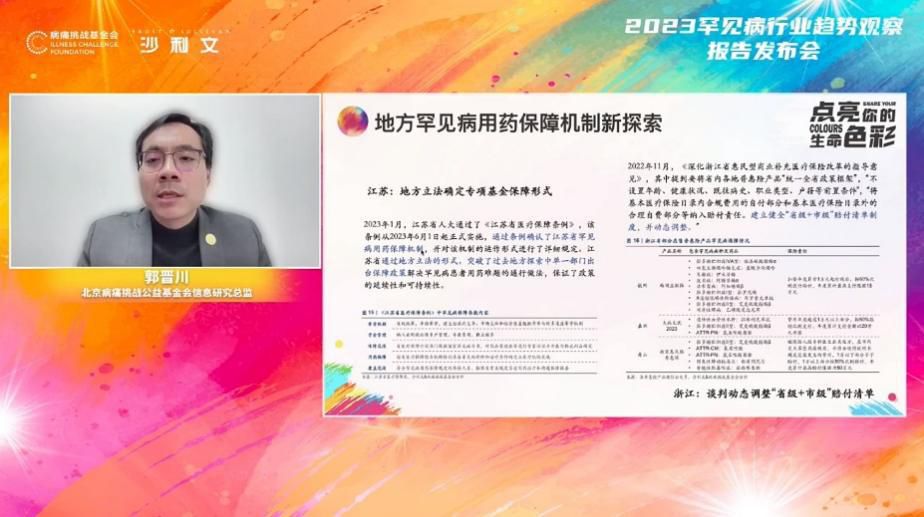
发布会上,病痛挑战基金会信息研究总监郭晋川从政策角度解读了《报告》。截至目前,基于《第一批罕见病目录》,103种药物在中国上市,涉及47种罕见病;其中73种药物已纳入医保,涉及31种罕见病。但目录外的高值药保障仍是患者用药可及的核心痛点,目前有16种罕见病的全部治疗药物均未纳入医保,其中13种药物属于高值药,年治疗费用多为几十万到上百万。从国家到地方上,各方都做了大量探索为解决罕见病的用药可及问题,如医保目录动态调整、地方罕见病用药保障机制新探索、公益慈善力量参与罕见病多层次保障等。
罕见病成全球热门投资赛道,国内出台17项利好政策
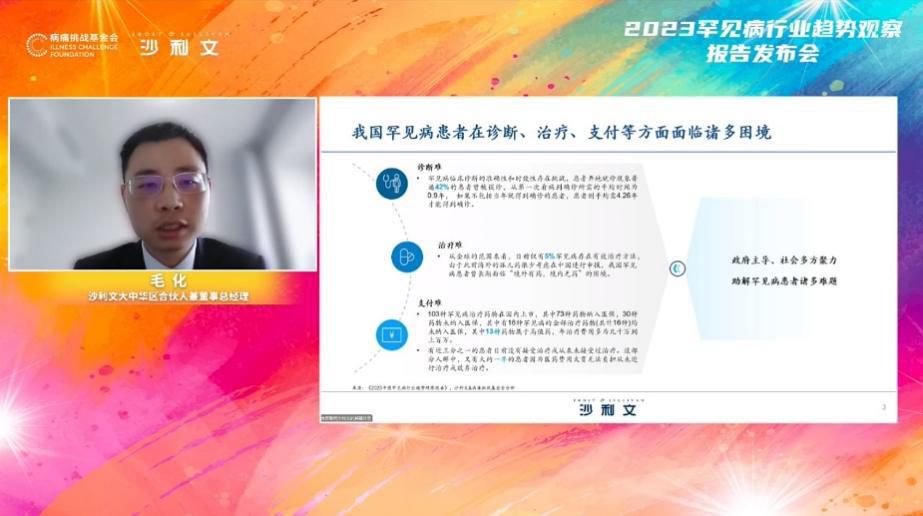
沙利文大中华区合伙人兼董事总经理毛化向大家介绍了六类鼓励罕见病药物研发及审评审批的政策举措:鼓励罕见病疾病药物研发、优先审评审批、豁免临床试验、给予减税优惠、纳入临时进口和市场独占期。受益于利好政策,我国在罕见病药物品种覆盖方面取得了一定的进展, 国内药企也逐渐参与罕见病药物的引进、研发与仿制。基于《第一批罕见病目录》,中国有81款罕见病药物正处于临床试验或上市申请阶段,其中46款药物为本土自主研发。
多方集聚,探讨罕见病政策和产业新方向
多位来自政策保障、产业和病友组织等的代表齐聚一堂,以《报告》为基础,共同探讨2023罕见病政策和产业走向何方。与会嘉宾都强调了政策顶层设计的重要性,并以江苏立法确定专项基金保障形式为例,探讨建立多层次保障的路径,希望通过多方参与保障罕见病支付问题最后的一百米,以免罕见病患者与政策带来的红利失之交臂。产业相关方也介绍了罕见病药物研发的高投入、周期长和短期回报低的特性,期待更多激励政策出现。
最后大家表达了对《报告》的期待,希望每年都能在报告里看到新的变化,连续、直观地展示国家对罕见病的关注,让罕见病患者获益,发挥对行业的积极引导作用。

2023年国际罕见病日期间,病痛挑战基金会还将举办《2023罕见病类特殊医学用途配方食品可及性报告》发布会、“Sing For Rare”罕见病公益主题音乐会,以及多场医患交流活动,相信在多方关注和努力下,罕见病群体将更有信心走向美好的未来!

 蒙公网安备 15010502001698号
蒙公网安备 15010502001698号